
Dans un article de blog précédent, nous avons abordé le principe de fonctionnement des tests de dépistage rapide basé sur le dosage à flux latéral (LFA). Dans ce blog, nous examinerons ce à quoi ressemblerait un tel test pour le dépistage du COVID-19. En outre, nous présenterons trois modèles qui permettent de comprendre ces micro-laboratoires simples, robustes, pourtant très avancés.
Comment fonctionnent les tests de COVID-19?
Quand l’organisme est infecté par le coronavirus, SARS-CoV-2, le système immunitaire réagit rapidement en produisant des anticorps. Les cellules dendritiques peuvent présenter des antigènes du virus qui permettent leur reconnaissance par les cellules T. Les cellules T peuvent activer les cellules B pour secréter des anticorps ciblant l’antigène (Ref. 1). Les anticorps IgM sont parmi les premiers à se créer. Ces anticorps s’attachent à la surface des antigènes sur les particules virales dès qu’elles s’approchent. Dans le cas du coronavirus, les antigènes peuvent correspondre aux protéines spike (péplomères) à la surface du virus (antigène S). Une fois fixé à l’antigène, l’anticorps bloque les protéines spike du virus, les empêchant de s’attacher aux cellules humaines et de les infecter. Le virus est ainsi neutralisé, puisqu’il n’est pas capable de se répliquer en dehors d’une cellule infectée. Il existe un certain nombre d’anticorps différents qui peuvent cibler des antigènes différents. Il convient de noter qu’il existe également d’autres mécanismes pour lutter contre l’infection. En outre, les cellules T qui reconnaissent le virus peuvent également cibler directement les cellules infectées. Elles peuvent activer l’autodestruction de ces cellules ou bien détruire elles-mêmes les cellules infectées, neutralisant ainsi le virus.
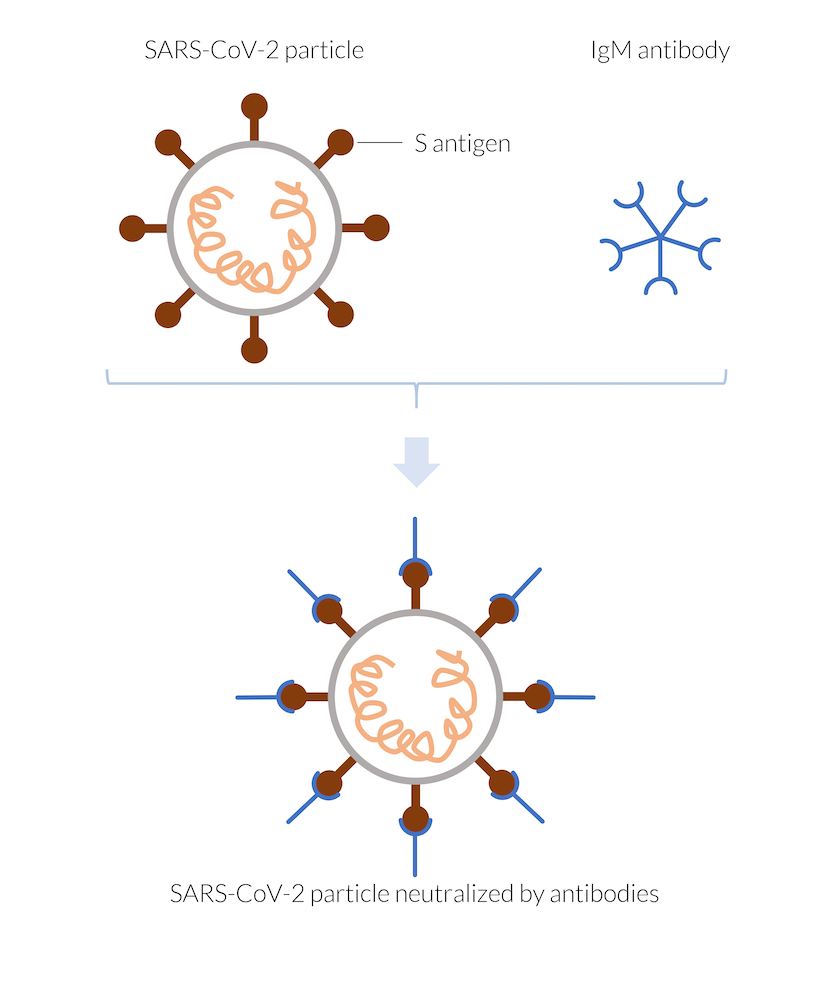
Les anticorps IgM fabriqués par le système immunitaire se fixent, par exemple, à l’antigène spike (antigène S) de la particule virale du SARS-CoV-2, neutralisant ainsi la particule. Le virus neutralisé ne peut pas pénétrer une cellule humaine et ne peut donc pas se répliquer. La particule virale est détruite.
Les anticorps IgM se déplacent dans l’organisme par groupes de cinq, formant des petites particules (ou de grandes molécules), et se fixant à chaque particule virale qu’ils rencontrent. A un stade plus avancé de l’infection, le système immunitaire produit également d’autres anticorps, par exemple, des IgG, qui se déplacent en solitaire dans l’organisme et se fixent à chaque particule virale qu’ils rencontrent. Les anticorps IgG sont plus longs à fabriquer par l’organisme, mais durent plus longtemps et confèrent une immunité tant qu’ils sont présents.
Certains des tests LFA de dépistage rapide du COVID-19 sont basés sur la détection des anticorps IgM et IgG. Ce sont ces tests qui seront examinés dans le modèle présenté dans cet article de blog.
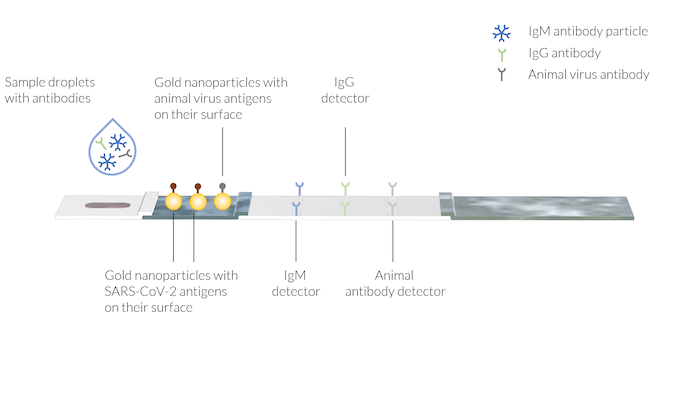
L’échantillon contient les anticorps humains IgM et IgG, créés suite à l’infection au COVID-19. Un anticorps animal est également ajouté à l’échantillon avec la solution tampon. Les lignes de tests comportent des détecteurs d’anticorps immobilisés sur trois zones différentes. Il convient de noter que les lignes de tests ne sont pas encore visibles.
Le sang (ou la salive) du patient peut être placé dans la zone de dépôt de l’échantillon suivi du réactif, en versant quelques gouttes de la solution tampon dans la zone de dépôt de l’échantillon.
L’échantillon est transporté par les forces capillaires jusqu’au tampon de conjugaison. Là, les anticorps IgM et IgG se fixent à un conjugué. Un conjugué peut être une nanoparticule dont la surface contient des antigènes du SARS-CoV-2. Deux complexes différents sont alors formés:
- IgM avec le conjugué (IgM-C)
- IgG avec le conjugué (IgG-C)
Ces complexes sont dissous dans le liquide de l’échantillon.
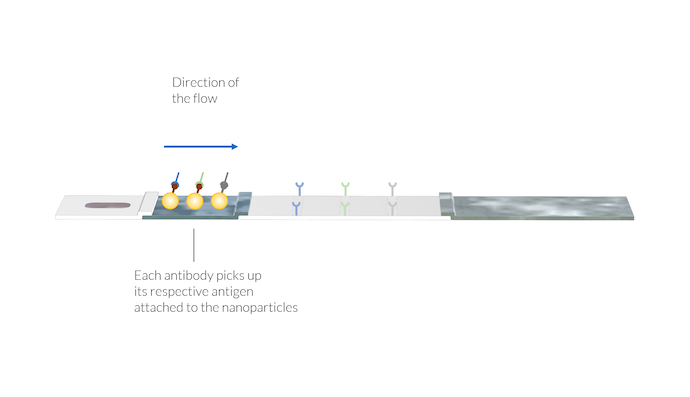
Les anticorps IgM et IgG captent les particules d’or en se fixant à l’antigène du SARS-CoV-2 se trouvant à la surface des particules. De même, l’anticorps du virus animal capte sa particule spécifique. Les complexes d’anticorps et de particules sont dissous dans l’écoulement et sont transportés vers la membrane avec l’échantillon. Notez à nouveau que les lignes de test ne sont pas encore visibles.
En outre, il peut y avoir un second conjugué composé d’antigènes de virus animaux attachés à des nanoparticules d’or. Ces conjugués peuvent se fixer à un anticorps animal de référence fourni par la solution tampon. Le complexe anticorps animal et conjugué (AA-C) est également dissous dans le liquide de l’échantillon et est utilisé pour une détection ultérieure dans la ligne de contrôle.
L’échantillon est ensuite transporté vers la membrane par les forces capillaires. Dans la première ligne de test, les détecteurs de IgM sont immobilisés à la surface de la membrane lors de sa fabrication. Ces détecteurs de IgM capturent les complexes IgM-C et les maintiennent stationnaires sur la ligne de test. Les nanoparticules s’accumulent et révèlent la présence du complexe sur la ligne de test en la colorant en rouge.
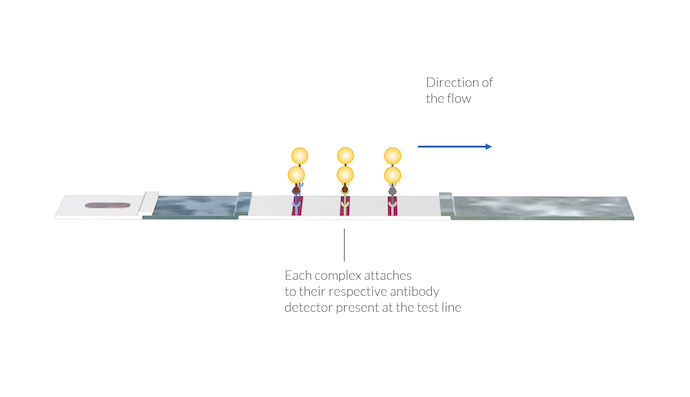
Les complexes anticorps-antigène-nanoparticule d’or s’attachent à leur détecteur d’anticorps spécifique présent au niveau des lignes de test. Une fois les complexes immobilisés sur la surface de la ligne de test, la couleur de cette dernière apparait, du fait de la présence des nanoparticules d’or à la surface.
De la même manière, le complexe IgG-C réagit avec les détecteurs IgG immobilisés sur la seconde ligne de test. Une fois le complexe IgG-C s’attache au détecteur IgG, la seconde ligne change de couleur et devient rouge en raison de la présence des nanoparticules d’or.
La ligne de contrôle réagit alors de manière analogue lorsqu’elle rencontre le complexe AA-C, en utilisant les détecteurs des anticorps animaux fixés à la membrane au niveau de la zone de la ligne de contrôle. La coloration de cette ligne indique que l’échantillon a traversé la zone de la membrane, y compris les zones de détection des IgM et IgG. Si la ligne de contrôle ne se colore pas, le test n’est pas valide, puisque l’échantillon n’a pas traversé la membrane d’une manière satisfaisante.
L’écoulement se poursuit jusqu’au tampon d’absorption (tampon à mèche). Le volume de pore de ce tampon détermine le volume de l’échantillon qui peut s’écouler à travers la bandelette de test. Lorsque la zone d’absorption est saturée, l’écoulement dans la bandelette s’arrête. La seule façon de rétablir l’écoulement est d’évaporer une partie de l’échantillon dans le tampon d’absorption.
Trois modèles de test de dépistage rapide dans COMSOL Multiphysics®
Trois modèles sont mis en place pour étudier un test de dépistage rapide LFA.
D’abord, un modèle 3D complet est utilisé pour déterminer si l’échantillon liquide est uniformément distribué dans la bandelette de test et pour étudier l’influence de la position de la zone de dépôt. Le modèle 3D permet également d’étudier la capacité d’absorption du tampon d’absorption qui permet d’assurer l’écoulement à travers la bandelette de test.
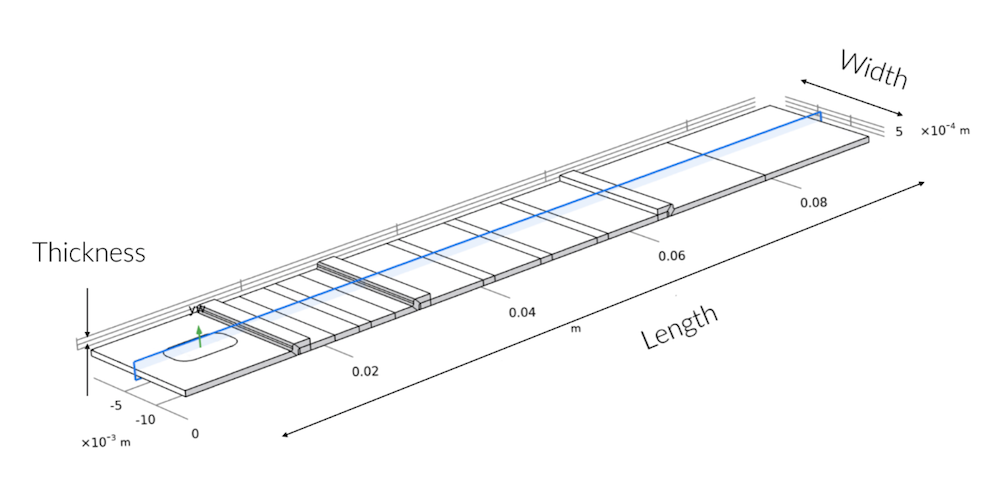
La section en bleu montre le plan de coupe 2D dans la géométrie 3D. Le défaut de symétrie sur la largeur ne se trouve qu’au niveau de la zone de dépôt de l’échantillon, où le puit ne s’étend pas sur toute la largeur de la bandelette de test.
On remarque assez vite qu’une fois passé la zone de dépôt, l’écoulement de l’échantillon forme un profil de vitesse plat. Cela signifie qu’il s’écoule uniformément sur toute la largeur de la bandelette de test. Cela implique qu’un modèle 2D est suffisant pour comprendre les enjeux et le fonctionnement du test de dépistage rapide, tant que la zone de dépôt assure une distribution uniforme de l’écoulement. Par conséquent, nous avons mis en place des modèles 2D pour étudier le transport et les réactions dans la bandelette de test. Ces modèles 2D nous permettent d’adopter une résolution plus élevée pour le maillage, à la fois sur la longueur et sur l’épaisseur de la bandelette.
Les modèles associent l’interface Equations de Richards pour l’écoulement en milieu poreux et l’interface Transport d’espèces diluées dans COMSOL Multiphysics® (Ref. 2). Les réactions qui forment les espèces complexes IgM-C, IgG-C, et AA-C sont définies par l’interface Chimie. De même, les réactions de surface au niveau des lignes de test sont définies par l’interface Chimie. Pour les modèles 2D, nous avons adopté deux approches différentes:
- Supposons que l’adsorption du complexe sur les lignes de test n’ait lieu qu’au niveau de la surface de la membrane
- Supposons que le processus d’adsorption lors de la détection se déroule sur toute l’épaisseur de la membrane en dessous de la position des lignes de test
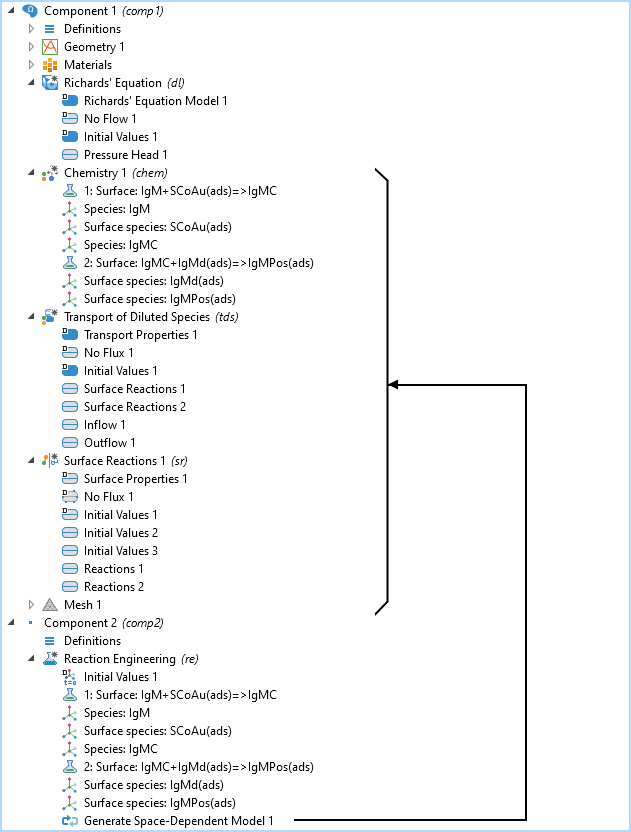
L’arbre du modèle comprenant le composant 2D avec les interfaces Equation de Richards, Chimie, Transport d’espèce diluées, et Réactions de surface, ainsi que le composant 0D avec l’interface Génie réactionnel. Le noeud Générer un modèle avec dépendance spatiale ajoute les interfaces de transport et de chimie au composant 2D déjà existant avec l’interface Equation de Richards.
L’arbre du modèle est illustré dans la figure ci-dessus pour le schéma réactionnel de l’IgM. Les interfaces Chimie, Transport d’espèces diluées, et Réactions de surface sont toutes créées par l’interface Génie réactionnel, où les réactions chimiques sont définies à l’aide de la fonctionnalité Générer un modèle avec dépendance spatiale.
Les réactions chimiques dans le tampon de conjugaison sont définies comme suit:
- La réaction entre IgM et l’antigène SARS CoV-2 sur la nanoparticule d’or dans le tampon de conjugaison est définie comme suit: IgM +SCoAu(ads) => IgMC
- Le terme (ads) indique que l’antigène et les nanoparticules sont adsorbés dans la structure poreuse du tampon de conjugaison et sont captés par l’IgM pour former le complexe IgMC, qui est dissous dans la solution.
- Nous obtenons la réaction analogue pour l’anticorps IgG: IgG + SCoAu(ads) => IgGC
- La réaction entre l’anticorps animal (AA) et l’antigène animal sur la nanoparticule d’or (AAu) peut être définie comme suit: AA + AAu(ads) => AAC
IgMC, IgGC, et AAC sont donc les complexes anticorps–conjugué.
Les réactions dans les lignes de tests sont les suivantes:
- Dans la première ligne de test, nous avons: IgMC + IgMd(ads) => IgMPos(ads)
- Illustrant le fait que le complexe IgMC réagit avec la protéine de détection IgMd adsorbée pour former l’espèce surfacique IgMPos adsorbée. La formation de l’IgMPos immobilisée donne à la première ligne de test sa couleur de détection.
- Par analogie au point 4 ci-dessus, dans la seconde ligne de test nous avons: IgGC + IgGd(ads) => IgGPos(ads)
- L’espèce IgPos adsorbée donne à la seconde ligne de test sa couleur rouge.
- Dans la troisième ligne de test, nous avons donc: AAC + AAd(ads) => AAPos(ads)
- L’espèce AAPos adsorbée donne à la ligne de contrôle sa couleur rouge.
Résultats du modèle
La figure ci-dessous montre le profil d’écoulement dans la bandelette de test à quatre moments différents. On peut voir qu’au début, les fronts de l’échantillon s’étendent plus loin le long du milieu de la bandelette, formant un profil légèrement parabolique. Ce profil parabolique est dû à la position de la zone de dépôt au milieu de la bandelette. Cependant, après 5 secondes, lorsque l’écoulement a déjà atteint environ un tiers du tampon conjugué, le profil de l’écoulement est plat (voir la dernière figure du précédent article de blog).
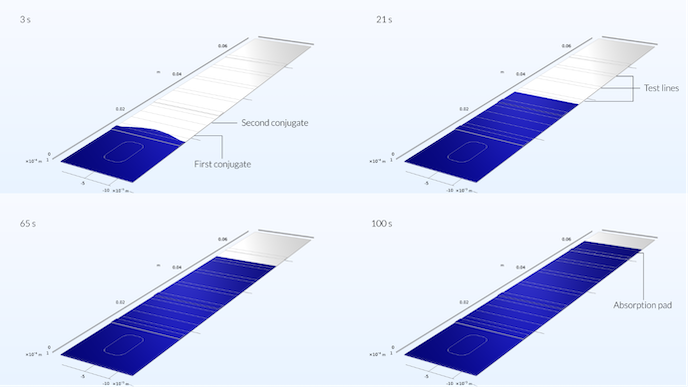
L’échantillon atteint déjà la première zone conjuguée après 3 secondes. Ici, on peut encore remarquer l’impact de la position de la zone de dépôt sur l’étalement de l’échantillon, puisqu’il n’est pas plat mais présente plutôt une portée maximale au milieu. Après 21 secondes, lorsque l’échantillon a atteint la première ligne de test, le profil de vitesse est une ligne droite. Après 65 secondes, l’écoulement a atteint la ligne de test de référence et après 100 secondes, il a atteint le tampon d’absorption.
Nous pouvons également constater sur ce graphique que la solution est symétrique le long d’un plan perpendiculaire à la bandelette de test situé au milieu du canal. Cela signifie que nous aurions pu résoudre le problème pour une moitié du dispositif seulement. Modéliser l’ensemble du dispositif, malgré le fait que le problème soit symétrique, est un bon moyen de vérifier que le maillage est suffisamment dense pour tirer des conclusions sur le profil de l’écoulement. Le fait que ce dernier soit symétrique nous indique que le maillage est peut-être suffisamment dense ici.
Examinons également le graphique de la vitesse d’écoulement de l’échantillon en nous positionnant à la première ligne de test; voir la figure ci-dessous. Nous pouvons voir que l’écoulement commence environ 20 secondes après que l’échantillon ait été déposé dans le puit. L’écoulement s’arrête vers 275 secondes. Cela coïncide avec le moment où le tampon d’absorption est saturé par l’échantillon liquide.
Ce qui est également intéressant c’est que le débit diminue avec le temps suivant une décroissance presque exponentielle. En effet, la force capillaire qui entraîne l’écoulement agit uniquement sur les surfaces des pores où l’échantillon liquide rencontre l’air (la zone limite triphasique du front liquide). Cela signifie que cette force est constante, tant qu’il y a un volume de pore vide à remplir avec l’échantillon. Toutefois, la résistance à l’écoulement augmente à mesure que l’échantillon pénètre dans la bandelette de test. La surface de la paroi des pores en contact avec l’échantillon qui s’écoule augmente avec le temps et donc aussi la surface de frottement entre les parois des pores et le liquide qui s’écoule.
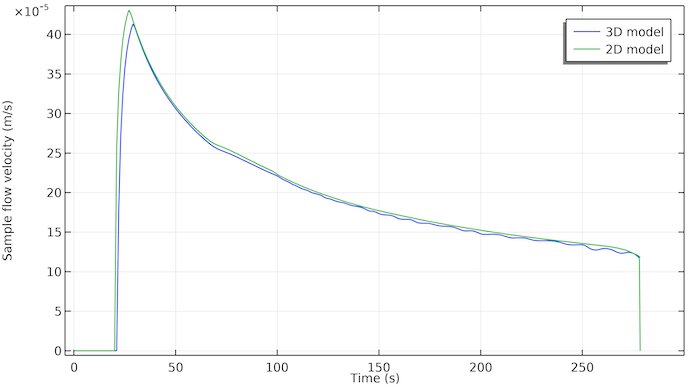
Vitesse d’écoulement de l’échantillon au niveau de la première ligne de test pour le modèle 3D (bleu) et le modèle 2D (vert). Les deux courbes sont relativement concordantes. Le modèle 3D montre un retard d’environ 2 secondes, qui est probablement dû au fait que l’échantillon doit d’abord s’écouler le long de la largeur. Dans le modèle 2D, l’échantillon est instantanément réparti uniformément sur la largeur.
La concentration du complexe IgMC est illustrée dans la figure ci-dessous pour différents pas de temps. On peut voir que les IgMC se déplacent avec l’écoulement jusqu’à ce qu’elles atteignent la première ligne de test. Là, elles sont consommées par la réaction avec l’espèce de détection IgM pour former la ligne de détection colorée. Le champ de concentration en IgMC montre qu’une couche limite de concentration se forme après avoir atteint la ligne de test. L’appauvrissement en concentration après la ligne de test continue à se développer avec le temps, mais la zone autour de la ligne de test atteint presque un état stable. Cependant, lorsque l’écoulement s’arrête, quand le tampon d’absorption est saturé par l’échantillon, une zone d’appauvrissement plus épaisse se forme sous la ligne de test, qui s’étend sur toute la membrane. De la même manière, la zone située sous la ligne de conjugaison est saturée par l’espèce IgMC.
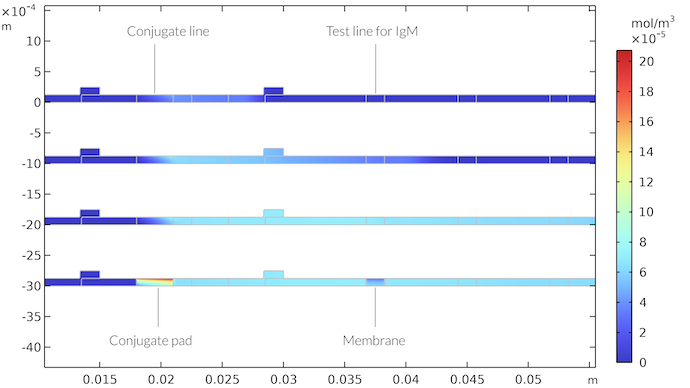
Concentration en IgMC en fonction du temps au niveau du tampon de conjugaison et dans la membrane. Les instants correspondent à 21 secondes (en haut), 65 secondes, 260 secondes et 410 secondes (en bas). Après 410 secondes, il n’y a plus d’écoulement dans la bandelette. Nous obtenons une zone à forte concentration d’IgMC dans le tampon de conjugaison et une zone à faible concentration d’IgMC sous la ligne de test pour l’IgM.
L’impact de l’écoulement est évident si l’on représente la concentration des espèces de détection à la surface de la ligne de test. L’augmentation des concentrations débute après un délai correspondant au moment où l’écoulement atteint la ligne de test concernée. La concentration augmente de façon presque linéaire au fur et à mesure que les IgMC sont adsorbées dans la zone de la ligne de test et que l’espèce de détection IgMPos est formée. L’augmentation linéaire signifie un taux d’adsorption constant. Lorsque l’écoulement s’arrête, en raison de la saturation du tampon d’absorption, le taux de formation d’IgMPos reste à peu près le même. Cela implique que, dans ce cas, la formation d’IgMPos est déterminée par la cinétique d’adsorption, c’est-à-dire qu’elle est déterminée par le taux d’adsorption des nanoparticules d’or dans l’IgMC sur le site d’adsorption. Si elle était contrôlée par le transport de masse, nous verrions un changement de la pente de la courbe et la croissance serait ralentie lorsque l’écoulement s’arrête. Cela pourrait bien évidemment changer si nous modifions la constante de vitesse pour la cinétique d’adsorption. La visibilité des lignes de test débute à environ 1·108 particules/mm2.
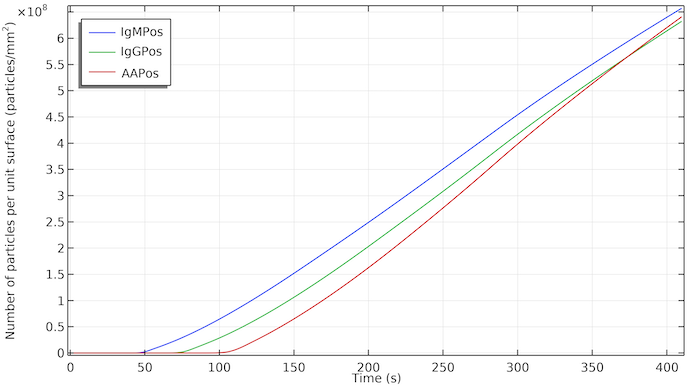
Concentration d’IgMPos, d’IgGPos et d’AAPos à la surface de leur ligne de test respective en fonction du temps. Les IgMPos et les IgGPos sont en compétition pour le même conjugué et par conséquent l’AAPos croît légèrement plus rapidement.
Ainsi, si la cinétique est similaire pour les trois lignes de test, on observera un retard dans l’apparition de la première, de la deuxième et de la troisième (ligne de contrôle) ligne de test dans cet ordre. En outre, chaque ligne test serait d’abord colorée sur le bord orienté vers l’écoulement, le reste des lignes de test apparaissant un peu plus tard.
Le modèle homogène donne des résultats similaires, si nous ajustons la cinétique pour l’adapter à ce cas. Cependant, le transport est ici beaucoup plus rapide, car les sites de réaction sont répartis sur toute l’épaisseur du tampon conjugué et, pour la ligne de test, sur toute l’épaisseur de la membrane. Les réactifs ne nécessitent pas d’être transportés jusqu’à la surface de la bandelette. Cela se traduit par un processus plus complexe, où la cinétique et le transport de masse limitent la révélation de la ligne de test. La figure ci-dessous montre la concentration d’IgMC correspondant au cas homogène.

La concentration d’IgMC dans le cas où le conjugué est présent sur toute l’épaisseur de la zone du tampon de conjugaison et où la ligne de test est présente sur toute l’épaisseur de la membrane. Les résultats sont similaires au cas hétérogène.
Le graphique ci-dessous montre l’apparition de la ligne de test. Nous pouvons voir qu’elle commence à se révéler presque uniformément avec une légère inclinaison dans la direction de l’écoulement. Lorsque l’écoulement s’arrête, nous obtenons une saturation de couleur plus élevée sur les deux bords de la ligne de test, car le transport du complexe anticorps–conjugué par diffusion vers ces bords est plus important.
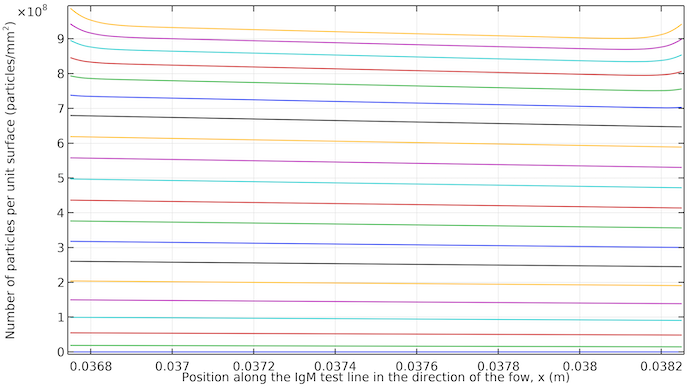
Concentration d’IgMPos par unité de surface intégrée sur une épaisseur de 10 μm au niveau de la ligne de test IgM. Les courbes vont de 20 secondes à 400 secondes avec des incréments de 20 secondes. Les courbes débutent à 20 secondes en bas (faible saturation) et se terminent à 400 secondes en haut (forte saturation). Après environ 260 secondes, les courbes sont plus rapprochées entre les pas de temps, car la diffusion est alors le seul moyen de transporter le complexe anticorps-conjugué vers la zone de la ligne de test, ce qui ralentit le processus.
La réalité se situe probablement entre le modèle homogène et le modèle hétérogène. On peut penser qu’une bonne approche pour obtenir une ligne de test qui soit colorée uniformément sur toute sa largeur serait d’avoir un volume de détection proche de la surface de la bandelette de test. De cette manière, le transport peut se faire dans les directions x et y, et en même temps nous obtenons une zone de réaction relativement grande (voir la figure ci-dessous). L’étalement de la zone de réaction sur toute l’épaisseur de la membrane, pour la ligne de test, ne contribue pas non plus à la visibilité du test, puisque la membrane n’est pas transparente. En revanche, il est avantageux que la zone de réaction du tampon de conjugaison soit répartie sur toute l’épaisseur, car cela maximise la réaction entre le conjugué et l’anticorps. De cette manière, le conjugué captera autant d’anticorps que possible.
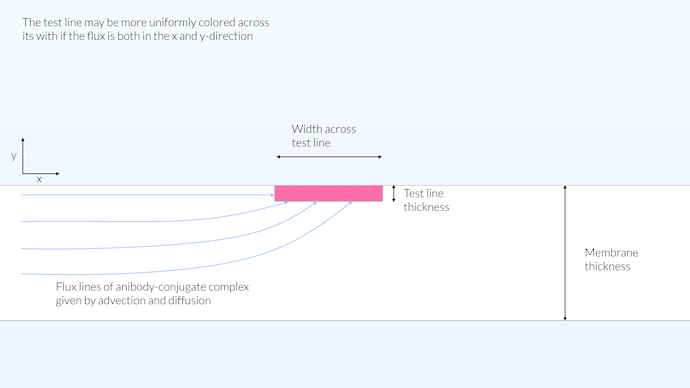
Dans cette configuration, la zone de réaction de la ligne de test n’est pas limitée à la surface mais n’est pas non plus répartie sur toute l’épaisseur de la membrane, elle est limitée à une épaisseur de 15 μm. La membrane n’est pas transparente, mais plutôt opaque avec une profondeur de visibilité d’environ 10 μm. L’épaisseur limitée de la ligne de test permet un transport sur toute la largeur de la ligne de test, ce qui donne une saturation de couleur relativement uniforme sur toute la largeur de la membrane.
Pour conclure
L’intervalle d’écoulement de l’échantillon sur la bande de test est déterminé par la taille du tampon d’absorption, qui détermine également la taille de l’échantillon. Cela est évident, bien sûr, et n’a rien de nouveau pour les scientifiques et les ingénieurs qui travaillent avec des dispositifs LFA. Ce qui est plus intéressant, c’est que le modèle prédit la décroissance exponentielle du débit au fur et à mesure que l’échantillon progresse sur la bandelette, ce qui est également bien connu des scientifiques du domaine, mais qui n’est peut-être pas totalement évident.
La simulation en 2D montre que le transport de masse dans la bandelette, dans le cas hétérogène, semble être lent, mais la cinétique d’adsorption semble dans tous les cas être un facteur limitant. L’écoulement semble distribuer rapidement l’échantillon sur la bandelette. Cependant, la réaction d’adsorption est si lente qu’elle limite encore la formation de l’espèce de détection au niveau des lignes de test dans le cas hétérogène. Dans le cas homogène, la cinétique est encore plus limitante, puisque le transport vers le site de réaction se fait directement dans la direction de l’écoulement et ne dépend pas de la diffusion, du moins tant que l’échantillon s’écoule. Cependant, ces résultats sont bien entendu liés aux données d’entrée que nous avons utilisées.
Les modèles créés pour cet article de blog sont schématiques en termes de chimie. Afin de les utiliser pour le développement réel de bandelettes de test, des efforts beaucoup plus importants doivent être faits dans la génération des données d’entrée pour la chimie et pour les propriétés des matériaux poreux. Néanmoins, les modèles incluent les phénomènes importants: des descriptions relativement détaillées du transport et des réactions.
Pistes d’améliorations du modèle
- Tenir compte de l’adsorption–désorption tout au long de la membrane: nous supposons ici que toutes les espèces se déplacent librement jusqu’à ce qu’elles soient adsorbées de manière permanente aux lignes de test.
- Un modèle d’écoulement diphasique plus précis. Nous avons utilisé un modèle simple d’écoulement diphasique pour le milieu poreux. Un modèle plus précis basé sur la méthode de champ de phase pourrait également être utilisé.
- Données d’entrée provenant d’un test spécifique publié dans la littérature scientifique: nous avons utilisé la même porosité et les mêmes propriétés de mouillage pour tous les tampons de l’assemblage de la bandelette de test. Les concentrations et la cinétique d’adsorption utilisent des données d’entrée qui génèrent des résultats raisonnables. Cependant, une recherche bibliographique devrait être effectuée afin d’utiliser des données réalistes pour les concentrations et la cinétique. Cependant, ces données varient selon les tests COVID-19 et chaque fabricant a sa propre procédure de préparation et de détection des échantillons. L’objectif de cet article de blog est de présenter des approches de modélisation possibles, et non de publier un article scientifique.
- Analyse de convergence en maillage. Cela montrerait la précision à laquelle on peut s’attendre dans les résultats de la simulation. Cela a été partiellement réalisé, et nous savons que les modèles engendrent une erreur numérique relativement faible. Mais cette analyse rigoureuse n’entre pas dans le cadre de cet article de blog.
Références
- L. Gutierrez, J. Beckford, and H. Alachkar, “Deciphering the TCR Repertoire to Solve the COVID-19 Mystery”, Trends in Pharmacological Sciences, vol. 41, no. 8, pp. 518–530, 2020, (https://www.cell.com/trends/pharmacological-sciences/fulltext/S0165-6147(20)30130-9),
- D. Rath and B. Toley, “Modelling-Guided Design of Paper Microfluidic Networks – A Case Study of Sequential Fluid Delivery”, ChemRxiv, 2020, https://doi.org/10.26434/chemrxiv.12696545.v1.
Téléchargez les modèles
Prêt à vous lancer dans la modélisation d’un test de dépistage rapide de COVID-19? Accédez aux fichiers des modèles en cliquant sur le bouton ci-dessous:






Commentaires (0)